文章摘要
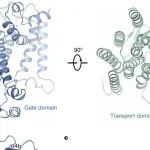
背景:cGAS-STING通路是细胞感知胞质异常DNA并启动先天免疫反应的核心信号轴,在抗感染、抗肿瘤及自身免疫病等多种生理病理过程中发挥关键作用。然而,经典模型无法解释为何STING必须离开内质网转运至高尔基体等囊泡结构才能完全激活。研究目的:为阐明STING激活的精确调控机制,特别是其转运依赖激活的必要条件。结论:两项《自然》背靠背研究共同揭示,内源性脂质信号分子PtdIns(3,5)P₂(磷脂酰肌醇3,5-二磷酸)是STING激活不可或缺的协同因子。研究发现,STING的完全激活需要cGAMP提供的危险信号与PtdIns(3,5)P₂提供的膜环境阈值信号双重满足。PtdIns(3,5)P₂(与胆固醇协同)直接结合STING,促进其二聚体的高阶寡聚化,从而为下游TBK1激酶的激活创造必要的分子环境。这一机制解释了STING必须从低PtdIns(3,5)P₂水平的内质网转运至高PtdIns(3,5)P₂水平的近核囊泡才能完全激活的原因,提供了避免信号误触发的安全阈值,并为相关疾病的治疗提供了新的潜在靶点。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。